2013年陕西普通高中会考化学真题
(时间90分钟 满分100分)
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 Cl:35.5 S:32 Zn:65
一、选择题(每小题2分,共20分。每小题只有一个选项符合题意)
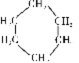 1、据报道,2011年某公司在生产手机等产品的触摸屏时,因使用环己烷 (如右图)作清洁剂造成工人中毒事故。环己烷属于( )
1、据报道,2011年某公司在生产手机等产品的触摸屏时,因使用环己烷 (如右图)作清洁剂造成工人中毒事故。环己烷属于( )
A.无机物 B.混合物 C.有机物 D.单质
2、下列物质中,既含离子键有含共价键的是( )
A.NaOH B.H2 O C.H2S D.NaCl
3、下列实验仪器可以用来加热但需要垫上石棉网的是 ( )
A.试管 B.量筒 C.蒸发皿 D.烧杯
4、下列说法正确的是( )
A.纯净的SiO2可用于制造计算机芯片
 B.光导纤维的主要成分是SiO2
B.光导纤维的主要成分是SiO2
C.太阳能电池的基本原料是SiO2
D.单质Si在常温下与任何物质都不反应
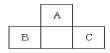
5、A、B、C均为短周期元素,它们在周期表中的位置如上图。已知 B、 C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是:( )
A.Be、Na、Al B.B、Mg、Si
C.C、Al、P D.O、P、Cl
6.下列实验操作或方法中,正确的是( )
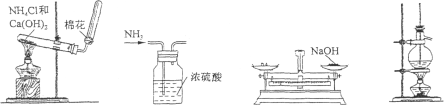
A.制取NH3 B.干燥NH3 C.称量NaOH固体 D.石油的分馏
7.下列反应中,属于氧化还原反应的是( )
A.NaOH+HCl= NaCl+H2O B.SO3+H2O= H2SO4
C.SiO2+2NaOH=Na2SiO3+H2O D.3NO2+H2O= 2HN03+NO
8.Al(OH)3即能与酸起反应,又能与强碱溶液起反应生成盐和水,说明Al(OH)3属于( )
A.两性氧化物 B.两性氢氧化物 C.盐 D.有机物
9.在生物科技领域,通过追踪植物中放射性P发出的射线,来确定磷在植物中的作用部位。该核素原子内的中子数为( )
A.15 B.17 C.32 D.47
10.配制100 mL0.100 mol·L-1Na2CO3溶液时,有下列步骤:①溶解 ②转移 ③定容 ④计算 ⑤称量,正确的顺序为( )
A.⑤④①②③ B.⑤④②①③ C.④⑤①②③ D.④③⑤①②
二、选择题(每小题3分,共30分。每小题只有一个选项符合题意)
11.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.水的摩尔质量为18g
B.常温常压下,48gO3含有的氧原子数为3NA
C.常温常压下,11.2L氧气中所含有的原子数为NA
D.2.3g金属钠变为钠离子时失去的电子数为NA
12、下列物质的性质比较,正确的是 ( )
A.酸性:H2SO4>HClO4
B.碱性:NaOH>KOH
C.非金属性: P>S>Cl
 D.气态氢化物稳定性:HF>HCl>H2S
D.气态氢化物稳定性:HF>HCl>H2S
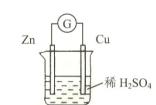
13.对右图所示装置的叙述,错误的是( )
A.锌是负极,其质量逐渐减小
B.电流由锌片经导线流向铜片
C.H+在铜片表面被还原,产生气泡
D.锌片上发生氧化反应,铜片上发生还原反应
14、已知化学反应C(s)+O2(g) ![]() CO2(g) 是放热反应。据此推断
CO2(g) 是放热反应。据此推断
下列说法正确的是 ( )
A.反应物的总能量大于生成物的总能量
B.反应物的总能量小于生成物的总能量
C.反应物的总能量等于生成物的总能量
D.无法确定反应物总能量和生成物总能量的相对大小
5.下列实验方法正确的是( )
A.用NaOH溶液鉴别SO2和CO2
B.用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体
C.用Na![]() 2CO3溶液鉴别HCl溶液和H2SO4溶液
2CO3溶液鉴别HCl溶液和H2SO4溶液
D.用焰色反应鉴别NaCl和NaNO3
16.对于恒容条件下的可逆反应:N2 (g)+ 3H2(g) ![]() 2NH3(g)。下列判断不正确的是( )
2NH3(g)。下列判断不正确的是( )
A.20s内,H2的浓度改变了0.60mol/L,则平均反应速率
υ(H2) = 0.030mol/(L·s)
B.当气体总压不随时间改变时,表明该反应达到平衡状态
C.使用催化剂可明显减少达到平衡的时间
D.达到化学平衡状态时,正、逆反应的速率都为0
17.下列各组离子中,能在溶液中大量共存的是( )
A.H+、Cu2+、OH- B.H+、Cl-、CO32-
C.Fe3+、Cl-、SO42- D.Na+、Ba2+、SO42-
18.下列反应属于加成反应的是( )
![]() A.
A.
![]() B.
B.
![]() C.
C.
![]() D.
D.
19、下列离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O===Na++2OH-+H2↑
B.铁粉投入到硫酸铜溶液中:Fe +Cu2+===Fe2+ +Cu
C.AlCl3溶液中加入足量的氨水:Al3++ 3OH-===Al(OH)3↓
D.澄清石灰水跟稀硝酸反应:Ca(OH)2+2H+===Ca2++2H2O
20.下列实验现象或结论错误的是( )
A.向某溶液中加入稀盐酸,无明显现象,再加BaCl2溶液,有白色沉淀生成,则原溶液中一定含有SO
B.向AlCl3溶液中逐滴加入NaOH溶液至过量,现象是先产生白色沉淀,后沉淀逐渐溶解
C.取某溶液进行焰色反应时,火焰呈黄色,则原溶液中一定含有K+
D.向某溶液中加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定含有NH
第二部分(非选择题 共50分)
三、填空题(共5小题,计30分)
21、(6分) 中学化学常见的A、B、C 三种物质,它们都含有同一种元素。A、B、C之间有下图的转化关系。已知A为生活中常见的金属单质,B的水溶液呈浅绿色。
![]() (1)A的名称为 ,B中含有的阳离子为 (填离子符号)。
(1)A的名称为 ,B中含有的阳离子为 (填离子符号)。
(2)检验C中阳离子常用的试剂为 。
A.KSCN B.KCl C.NaNO3 D.MgSO4
22.(5分)木炭与浓H2SO4加热反应的化学方程式为:C+2H2SO4(浓)CO2+2SO2+2H2O。为检验该反应的三种产物,某课外兴趣小组设计了如下装置进行实验(夹持装置未画出)。
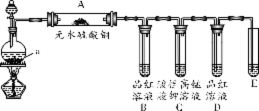
请回答下列问题:
(1)仪器a的名称是 。
(2)装置A中观察到的现象是 。
(3)装置B的作用是 。
(4)装置E中的试剂为 ,用于检验 。
23.(7分)X、Y、Z、W都是短周期元素,其中X、W位于同一主族,Y、Z、W位于同一周期;X元素的原子核外有两个电子层,最外层有7个电了;Y是短周期元素中最活泼的金属元素,Z元素的最高化合价为+3价。
(1)写出元素符号:X 、Z 。
(2)比较Y和Z的最高价氧化物对应水化物的碱性: > (填化学式)。
(3)写出W元素的原子结构示意图: 。
(4)写出Z元素最高价氧化物与稀硫酸反应的离子方程式: 。
24.(6分)下图中A、B为常见气体单质,B为黄绿色气体,C为生活中常见金属。
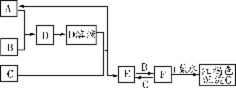
请按要求填空:
(1)分别写出B、D、G的化学式:B 、D 、G 。
(2)能检验E溶液是否变质的试剂为 (填序号)。
①氯水 ②KSCN溶液 ③盐酸 ④O2
(3)写出F溶液与C单质反应的离子方程式: 。
25.(6分)向200 mL 0.5 mol·L-1H2SO4溶液中投入足量的锌,充分反应。计算:
(1)标准状况下生成H2的体积。
(2)所得溶液溶质物质的量浓度。(假定反应前后溶液体积不不发生变化)
四、选答题(共3小题,计20分。试题分为A题、B题和C题,各位考生只可选作一种题。选学《化学与生活》模块的考生答A题,选学《化学反应原理》模块的考生答B题,选学《有机化学基础》模块的考生答C题。若选答了多个模块的试题,只以答在前面的一个模块成绩计分,不跨模块计分)
A 《化学与生活》
26.(6分)下表为某食品包装袋上的说明书:
芝麻酱每100 g含有
蛋白质:19.2 g 脂肪:52.7 g 碳水化合物16.8 g
维生素 A:17 μg 铁:50.3 mg 硒:4 μg
(含钙:相当 于300 g豆腐,含铁:相当于800 g鸡蛋)(提醒:芝麻酱可引起部分婴儿过敏性皮炎)
(1)选择说明书中的物质回答下面的问题:
①能水解生成氨基酸的物质是 。
②若人体缺少 ,易患夜盲症。
(2)对芝麻酱说明书的判断正确的是 (填序号)。
A.不含微量元素 B.不含糖类和油脂
C.婴儿最不宜食用 D.钙含量低于豆腐和鸡蛋
27、(6分)(1)金属的腐蚀现象非常普遍,下列各种方法:①金属表面涂抹油漆;②改变金属内部结构;③保持金属表面清洁干燥;④在金属表面进行电镀;⑤使金属表面形成致密的氧化物薄膜。以上方法对金属起到防护或减缓腐蚀作用的是( )
A.①②③④ B.①③④⑤ C.①②④⑤ D.全部
(2)材料是人类赖以生存和发展重要物质基础。下列材料中:
①硬币 ②光导纤维 ③橡胶 ④氮化硅陶瓷
属于无机非金属材料的是 (填序号)。
属于有机高分子材料的是 (填序号)。
28.(8分)保护生存环境,保护地球已成为全人类的共识。
(1)在①核燃料泄漏、②白色污染、③酸雨、④淀粉水解这4个事实中,和环境污染无关的是 (填序号)。
(2)下列能造成水体污染的是 (填序号)。
A.电镀厂氰化物的任意排放 B.海上油轮原油的泄漏
C.使用O3作消毒剂 D.使用适量明矾作净水剂
(3)2011年3月11日,日本发生强烈地震,造成多处油库爆炸,释放出大量有毒有害气体,该气体属于 (填“纯净物”或“混合物”)。
(4)汽车给市民生活带来便捷的同时,也造成了环境污染。汽车尾气中含有CO和NO,为了消除这两种物质对大气的污染,可在汽车的排气管上装一个“催化转化器”,使它们发生反应生成两种参与大气循环的气体。该反应的化学方程式为 。
B 《化学反应原理》
26、(6分)在一定条件下,反应N2(g)+3H2(g)![]() 2NH3(g);ΔH<0,在体积为1 L的恒容容器中充入1 mol N2和3 mol H2。20 min后达到平衡,此时测得N2的浓度为0.9 mol·L-1。
2NH3(g);ΔH<0,在体积为1 L的恒容容器中充入1 mol N2和3 mol H2。20 min后达到平衡,此时测得N2的浓度为0.9 mol·L-1。
(1)该反应为 反应(填“吸热”或“放热”)。
(2)从反应开始到20 min这段时间内,用H2表示该反应速率为 mol·L-1·min-1。
(3)平衡时若保持容器体积不变,减小NH3浓度,平衡 移动(填“向右”“向左”或“不”)。
27、(6分)(1)常温下,FeCl3溶液的pH 7(填“>”“<”或“=”),其原因是 (用离子方程式表示)。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至溶液呈中性,则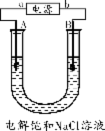 c(Na+) c(CH3COO-)(填“>”“<”或“=”)。
c(Na+) c(CH3COO-)(填“>”“<”或“=”)。
28.(8分)电解饱和食盐水是氯碱工业的基础。以下是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水。通电几分钟后,将湿润的碘化钾淀粉试纸放在A电极一端的管口,试纸变蓝色。请回答:
(1)A极为 极(填“阴”或“阳”)。b端为 极(填“正”或“负”)。
(2)写出B极的电极反应式 。
(3)停止电解时,测得电路中共转移电子0.02 mol,则标准状况下A极生成气体的体积为 L。
(4)电解过程中溶液的pH (填“增大”“减小”或“不变”)。
C 《有机化学基础》
26.(6分)已知下列物质的结构
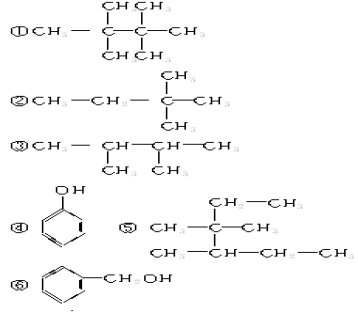
(1)其中互为同分异构体的是 (填序号)。
(2)能与FeCl3溶液反应是紫色的是 (填序号)。
(3)下列对⑤的命名正确的是 (填序号)。
A.2,3—二甲基—2—乙基戊烷 B.3,4,4—三甲基乙烷
C.3,3,4—三甲基己烷 D.2,3—二甲基—3—乙基戊烷
27.(6分)
(1)蛋白质是人体必需的营养物质之一,氨基酸是组成蛋白质的基本结构单元,结构简式为![]() ,其分子中一定含有氨基(-NH2)和 (填结构简式或名称),
,其分子中一定含有氨基(-NH2)和 (填结构简式或名称),
(2) 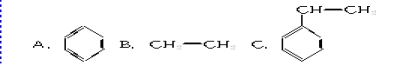 聚苯乙烯
聚苯乙烯![]() 是一种重要的合成材料,其单体的结构简式为( )
是一种重要的合成材料,其单体的结构简式为( )
(3)1-溴丙烷(CH3CH2CH2Br) (填“能”或“不能”)与硝酸银溶液反应生成溴化银沉淀
28、(8分)已知A、B、C、D、E均为含有C、H、O元素的有机物,它们之间的相互转化关系如图所示。其中B是生活中一种常见的有机物。
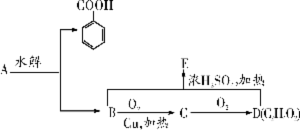
回答下列问题:
(1)检验C中官能团所加的试剂为 。
(2)除去E中所含少量杂质D,应加入的试剂是 (填序号)。
A.NaOH溶液
B.饱和Na2CO3溶液
C.乙醇溶液
(3) A的结构简式为 。
(4)写出由B物质与D物质反应生成E的化学方程: 。