2020年![]() 青海普通高中会考化学真题
青海普通高中会考化学真题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。第I卷1至4页,第II卷5至8页。满分100分,考试时间90分钟。
本试卷(I、II) 为试题卷,不允许作为答题卷使用,答题部分请在答题卡上作答。
本卷可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 C1-35.5 S-32 Cu-64
第I卷 (选择题共50分)
注意事项:
1.答第I卷前,考生务必将自己的姓名、报考证号涂写在答题卡上。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。不能答在试题卷上。
一、选择题(本题包括25小题,每小题2分,共50分。在下列各题的四个选项中,只有一个选项符合题意)
1.下列资源的开发利用过程中,只发生物理变化的是
A.石油分馏 B.石油裂化 C.高炉炼铁 D.从海水中提取镁
2.根据物质的组成与性质进行分类,HClO 属于
A.氧化物 B.酸 C.碱 D.盐
3.铝的核素![]() 中的“27”表示的是
中的“27”表示的是
A.质量数 B.质子数 C.中子数 D.电子数
4.当光束通过下列分散系时,可能产生丁达尔效应的是
A.泥浆 B.稀盐酸 C. NaCl 溶液 D.氢氧化铝胶体
5.实验室制取下列气体时,不能用排空气法收集的是
A. H2 B. CH4 C. NO D. NO2
6.、下列变化必须加入还 原剂才能发生的是
A. CO2→CO B. NH3→NO
C. SO2→H2SO3 D. CuO→CuCl2
7.下列物质中,能作为制备木材防火剂原料的是
A.硅酸钠 B.氢氟酸 C.碳酸钠 D.漂白粉
8.下列仪器名称错误的是
A.酒精灯 B.圆底烧瓶
B.圆底烧瓶![]()
C.量筒![]() D.烧杯
D.烧杯![]()
9.在含有大量Na+、HCO3-、Cl-的溶液中,还可能大量存在的离子是
A. Ag+ B. OH- C. NO3- D. H+
10.工业上常用电解法冶炼活泼金属。下列金属使用电解法冶炼的是
A.钠 B.铁 C.铜 D.金
11.分别灼烧下列各组溶液,火焰呈黄色是
A. NaCl溶液 B.稀盐酸 C. K2CO3 溶液 D. CuCl2 溶液
12.下列物质互为同分异构体的一组是
A.![]() 和
和![]() B.白磷和红磷
B.白磷和红磷
C. CH3CH2OH 和CH3OCH3 D. CH4和C2H6
13.下列化学用语表示正确的是
A.乙醇的结构式:C2H6O B.氯化氢的电子式:![]()
C. Mg2+的结构示意图:![]() D. CaCl2的电离方程式:CaCl2=Ca2++ Cl22-
D. CaCl2的电离方程式:CaCl2=Ca2++ Cl22-
14. 下列物质中,属于共价化合物的是
A. MgCl2 B. CO2 C.H2 D. NaOH
15.下列因素能减慢H2O2溶液分解反应速率的是
A.加入MnO2 B.降低温度 C.升高温度 D.增大H2O2的浓度
16.用NA表示阿伏加德罗常数的值,下列说法正确的是
A. CO的摩尔质量是28 g
B.常温常压下,1 mol N2的体积是22.4 L
C.18 g H2O中含有的氢原子总数为2NA
D.0.1 mol/L Na2SO4溶液中,Na+的物质的量浓度为0.1 mol/L
17.下列物质中,不属于高分子化合物的是
A.蛋白质 B.纤维素 C.淀粉 D.油脂
18.某课外小组同学通过实验发现钾和钠的化学性质相似。下列解释最合理的是
A.都属于金属元素 B.原子的最外层电子数相同
C.元素的最高正化合价相同 D.原子半径相差不大
19.下列属于吸热反应的是
A.氢气在氯气中燃烧 B.过氧化钠与水反应
C.氢氧化钠与盐酸反应 D. Ba(OH)2 ·8H2O与NH4Cl固体反应
20.下列关于铝的叙述中,正确的是
A.铝是地壳中含量最多的元素 B.铝在常温下不能与氧气反应
C.铝不能与强酸或强碱发生反应 D.电解熔融的氧化铝可制得铝单质
21.关于下图所示原电池装置,下列说法正确的是
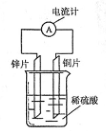
A.锌片为负极 B.铜片上发生氧化反应
C.电子由铜片通过导线流向锌片 D.该装置能将电能转变为化学能
22.甲烷和乙烯是两种重要的有机物,区分它们的正确方法是
A.观察两者的颜色 B.观察两者的状态
C.通入酸性高锰酸钾溶液 D.通入氢氧化钠溶液
23.在密闭容器中充入2 mol SO2和2 mol O2,一定 条件下发生反应:2SO2+O2![]() 2SO3,达到反应限度时,容器中SO3的物质的量可能是
2SO3,达到反应限度时,容器中SO3的物质的量可能是
A.1 mol B.2 mol C.3 mol D.4 mol
24.下列离子方程式正确的是
A.铁和稀硫酸反应:2Fe+6H+=2Fe3++ 3H2↑
B.钠与水反应:Na+ 2H2O= Na++ 2OH-+H2↑
C.氯气通入水中:Cl2+ H2O= 2H++Cl- +ClO-
D. NaHCO3 溶液与盐酸反应:H++ HCO3- =CO2↑+H2O
25.下列实验方案能达到目的的是
A.用浓硫酸干燥NH3
B.用BaCl2溶液鉴别AgNO3溶液和Na2SO4溶液
C.用加热的方法除去NaCl固体中的少量NaHCO3
D.用KSCN溶液鉴别FeCl3溶液和FeSO4溶液
第II卷 (非选择题共50分)
二、填空题(本大题包括5小题,共33分)
26.(6分)改善生态环境、建设美丽家园是全人类共同的呼声。
(1)酸雨是指pH_______5.6 (填“>”或“<”)的降水;_______ (填“SO2”或 “N2")是形成酸雨的主要气体之一。
(2)水是生命之源,净化水中的细小悬浮颗粒时,常加入_______ (填“食盐”或 “明矾”)使其聚集成较大颗粒沉淀而与水分离。
(3)汽车尾气中的CO和NO在催化剂作用下发生反应生成CO2和N2,该反应的化学方程式为________________。
(4)“垃圾分类”成为时代新风尚,下列属于可回收标志的是________(填字母序号)。
a.  b.
b.  C.
C. 
27. (7 分)常见金属和非金属及其化合物是化学研究的重要内容。回答问题:
(1)常温下,金属钠露置在空气中会发生变化,实验室通常把钠保存在____ (填 “煤油”或“水”)中。钠在空气中燃烧生成淡黄色的______ (填化学式)。
(2)实验室制取氢氧化铝时,常用铝盐溶液和________(填“氨水”或“氢氧化钠溶液”)作为原料。
(3) 向FeCl3溶液中加入足量NaOH溶液,可以观察到的现象是_______,向FeCl2溶液中滴入新制的氯水,反应的离子方程式为:2Fe+Cl2= 2____+2Cl-。
(4)氯气在通常情况下是______(填“无”或“黄绿”)色的有毒气体,工业上将氯气通入冷的消石灰中可制得漂白粉,漂白粉的有效成分是______ ( 填化学式)。
28.(4分)已知下列四种有机物:
A.乙烯 B.苯 C.乙醇 D.乙酸
(1)能作植物生长调节剂的是_____ (填字母序号)。
(2)在医疗上常用其75%的溶液作杀菌消毒剂的是______(填字母序号)。
(3)能使紫色石蕊试液变红的是________(填字母序号)。
(4)欲从碘水中萃取碘单质,选取的萃取剂为_____ ( 填字母序号)。
29. (10 分)下图是元素周期表的一部分,针对表中①~⑦元素,填写下列空白:
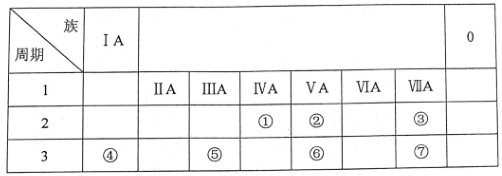
(1)②表示的元素是____ (填元素符号)。
(2)被选作相对原子质量标准的核素是_______(填字母序号)。
a. ![]() b.
b. ![]() c.
c.![]() d.
d.![]()
(3)②和⑥两种元素的原子半径大小为:②_____⑥(填“<”或“>”)。
(4)④和⑤两种元素的金属性强弱顺序为:④____⑤(填“<”或“>”)。
(5)元素④与⑦形成的化合物属于_______ (填“共价”或“离子”)化合物。
(6)最高价氧化物的水化物中,酸性最强的化合物的是______(填字母序号,下同),碱性最强的化合物的是_________。
a. NaOH b. HNO3 c. HCIO4 d. Al(OH)3
(7)在①~⑦元素中,最高价氧化物是两性氧化物的元素在第_____族,写出它的氧化物与氢氧化钠溶液反应的离子方程式_____________________。
30. (6 分)有机化合物是中学化学研究的主要内容。A、B、C、D都是含碳的化合物,它们之间的转化关系如图所示(部分反应条件和生成物已略去)。回答下列问题:
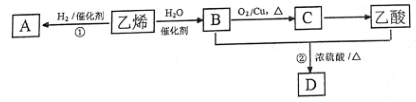
(1) A的结构简式为________;B的名称为_____________。
(2)乙酸中所含官能团的名称是____________(填“羟基”或“羧基”)。
(3)反应①的反应类型为____________,反应②的化学方程式为:_______________________。
三、实验题(本大题包括2小题,共11分)
31.(4分)实验小组需要配制100 mL0.5 mol/L的Na2CO3溶液,同学们分工合作进行实验。
(1)甲同学需要称取Na2CO3固体的质量是_____________g。
(2)乙同学溶解Na2CO3固体时,需要用到的仪器有:量筒、烧杯和___________。
(3)丙同学的下列操作中,正确的是_____________。
A.转移液体时,不慎将溶液洒落在容量瓶外
B.液面离容量瓶颈刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水
C.溶液配制完成后,长期将溶液储存在容量瓶中
(4)若在定容时俯视刻度线,则此操作导致所配Na2CO3溶液的物质的量浓度________(填“偏高”或“偏低”)。
32.(7分)研究性学习小组的同学们按下图装置进行SO2的制备及性质探究实验。
(查阅资料得到SO2气体的制备原理:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O),回答问题:
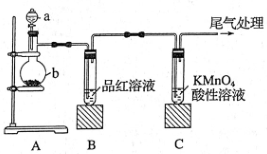
(1)图中a的仪器名称是_______, 亚硫酸钠应放在_________(填“a”或“b”)中。
(2)实验过程中,可以观察到装置B中品红溶液_______(填实验现象),该现象说明SO2具有_____性(填“氧化”、“还原”或“漂白”)。
(3)酸性条件下,SO2 与KMnO4在发生如下反应:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,使溶液褪色。反应中SO2是________(填“氧化”、“还原”剂),当0.5 mol SO2参加反应时,转移电子的物质的量是_______mol。
(4)尾气可采用________溶液吸收。
四、计算题(本大题包括1小题,共6分。要求写出计算过程)
33. (6分)实验室里常用一定量的氯化铵 与足量熟石灰混合加热制取氨气(反应方程式为:2NH4Cl+ Ca(OH)2![]() CaCl2+2NH3↑+2H2O),标准状况下,生成4.48 L氨气。计算:
CaCl2+2NH3↑+2H2O),标准状况下,生成4.48 L氨气。计算:
(1)生成氨气的物质的量是____________mol。
(2)参加反应的氯化铵的质量是多少?
(3)若将标准状况下4.48 L氨气溶于水配成500 mL溶液,所得溶液中氨水的物质的量浓度是多少? _________( 忽略氨水的电离)。