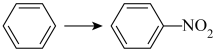
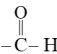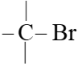2020-2021年北京市朝阳区高二化学下学期期末试题及答案
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23
第一部分(选择题,共42分)
每小题只有一个选项符合题意。共14个小题,每小题3分,共42分
1. 下列做法中利用蛋白质变性的是
A. 将淀粉水解为葡萄糖 B. 将花生油催化加氢制人造脂肪
C. 利用医用酒精、紫外线杀菌消毒 D. 使用醋酸除去水垢
2. 下列叙述不正确的是
A. ![]() 是直线形分子
是直线形分子
B. ![]() 晶体溶于水时,破坏了离子键
晶体溶于水时,破坏了离子键
C. ![]() 空间结构呈三角锥形,存在手性异构体
空间结构呈三角锥形,存在手性异构体
D. 金刚石是典型的共价晶体,熔点高,硬度大
3. 乙烯是石油化学工业的重要原料,其产量可以用来衡量一个国家石油化学工业的发展水平。下列关于乙烯的说法不正确的是
A. 含σ键、π键 B. 化学键均为非极性共价键
C. 碳原子均采取sp2杂化 D. 所有原子均位于同一平面
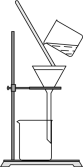
4. 某粗苯甲酸样品中含有少量氯化钠和泥沙。用重结晶法提纯苯甲酸的实验步骤中,下列操作未涉及的是
|
|
|
|
A.加热溶解 | B.冷却结晶 | C.萃取后分液 | D.趁热过滤 |
A. A B. B C. C D. D
5. 下列性质比较中,正确的是
A. 沸点:![]()
B. 热稳定性:![]()
C. 酸性:![]()
D. 在水中的溶解度:![]()
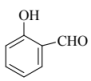
6. 下列各组化合物中,不互为同分异构体的是
A. ![]() 、
、![]()
B. ![]() 、
、
C. 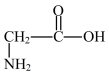 、
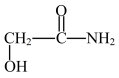
、
D. ![]() 、
、![]()
7. 有机物M由C、H、O三种元素组成,可作为溶剂从中草药中提取青蒿素。有关M的结构信息如下:
ⅰ.M![]() 红外光谱显示有C-H、C-O的吸收峰,无O-H的吸收峰。
红外光谱显示有C-H、C-O的吸收峰,无O-H的吸收峰。
ⅱ.M的核磁共振氢谱(图1,两组峰面积之比为2:3)、质谱(图2)如下所示。
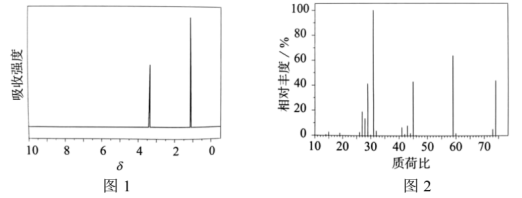
下列分析不正确的是
A. M不属于醇类物质 B. M的分子中含羧基和醛基
C. M的结构简式为![]() D. M的相对分子质量为74
D. M的相对分子质量为74
8. 下列操作不能达到实验目的的是
目的 | 操作 | |
A | 检验醛基( |
|
B | 证明酸性:碳酸>苯酚 | 向澄清的苯酚钠溶液中通入二氧化碳气体 |
C | 检验碳卤键( | 向试管里加入几滴1-溴丁烷,再加入 |
D | 鉴别甲苯与苯 | 向两支分别盛有2mL苯和甲苯的试管中各加入几滴酸性高锰酸钾溶液,振荡 |
A. A B. B C. C D. D
9. 下列物质转化中,所用的试剂、条件不合理的是
物质转化 | 试剂、条件 | |
A |
| NaOH的乙醇溶液、加热 |
B |
| 浓硝酸与浓硫酸、50~60℃ |
C | 油脂→ | NaOH水溶液、加热 |
D |
| 浓硫酸、140℃ |
A. A B. B C. C D. D
10. 阿司匹林的有效成分是乙酰水杨酸(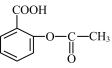 )。关于乙酰水杨酸的下列说法中不正确的是
)。关于乙酰水杨酸的下列说法中不正确的是
A. 分子式为![]()
B. 可发生加成、水解、酯化反应
C. 与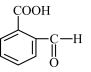 互为同系物
互为同系物
D. 水解产物之一能与![]() 溶液发生显色反应
溶液发生显色反应
11. 丙酮与甲醛具有相似的化学性质,均能与苯酚发生反应。有机物Q具有高阻燃性能,其制备过程如下所示(部分产物未列出)。
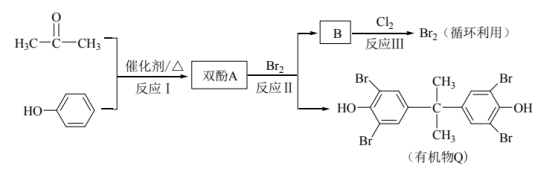
下列分析不正确的是
A. 苯酚与双酚A均能与NaOH溶液反应
B. 反应Ⅱ为取代反应
C. 反应Ⅲ为![]()
D. 反应Ⅰ为加成反应,原子利用率100%
12. 2020年我国科研团队鉴定出了蝗虫挥发出的能使之群聚的信息素——具有高生物活性的4-乙烯基苯甲醚(4VA)。这一发现具有重要的理论意义和应用价值。下列分析不正确的是
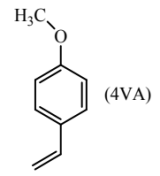
A. 4VA不存在顺反异构体
B. 4VA易溶于水,易被空气氧化
C. 4VA具有醚键、碳碳双键等官能团
D. 4VA的发现有助于设计合成新物质以阻止蝗虫群聚
13. “杯酚”(图b)分离C60和C70的过程(图a)示意如下:
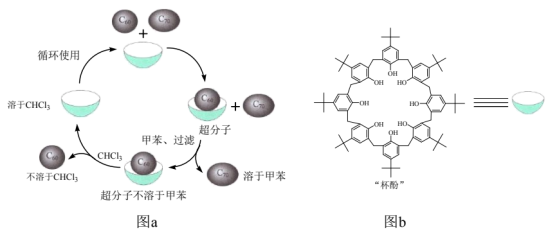
下列分析不正确的是
A. “杯酚”分子内能形成氢键
B. 图b所示的“杯酚”可由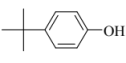 、HCHO合成
、HCHO合成
C. 图a反映了超分子具有“分子识别”的特性
D. 图a利用了C60不溶于甲苯,C70易溶于CHCl3的性质
14. 实验:①将少量白色![]() 固体溶于水,得到蓝色溶液;将少量
固体溶于水,得到蓝色溶液;将少量![]() 固体溶于水,得到无色溶液;
固体溶于水,得到无色溶液;
②向蓝色溶液滴加氨水,首先形成难溶物,继续添加氨水并振荡试管,难溶物溶解,得到深蓝色透明溶液;
③向深蓝色透明溶液加入乙醇,析出深蓝色晶体。
下列分析不正确的是
A. ①中蓝色溶液中呈蓝色的物质是![]() 离子
离子
B. ②中形成难溶物的反应为![]()
C. ②中难溶物溶解的反应为![]()
D. ③中加入乙醇后析出的深蓝色晶体是![]()
第二部分(非选择题,共58分)
15. 将CO2转化为CO是利用CO2的重要途径,由CO出发可以制备多种液体燃料。
(1)我国在CO2催化加氢制取汽油方面取得突破性进展,转化过程如下所示。
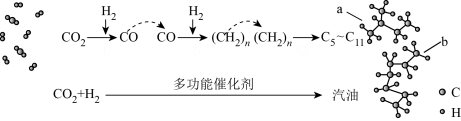
①图中a的名称是_______。
②CO2、a中碳原子的杂化轨道类型分别为_______。
(2)Cu、Cu2O可应用于CO2转化CO的研究。以CuSO4·5H2O、Na2SO3、Na2CO3为原料能制备Cu2O。
①![]() 空间结构为平面三角形的是_______。
空间结构为平面三角形的是_______。
②[Cu(H2O)4]2+离子中,配体是_______。
③除配位键外,CuSO4·5H2O中存在的化学键还有_______。
④将生成Cu2O的反应补充完整。______
![]()
(3)在Cu催化剂作用下,反应![]() 的可能机理如下。
的可能机理如下。
ⅰ.![]()
ⅱ._______。(写出反应方程式)
(4)Cu的晶胞(图1)、Cu2O的晶胞(图2)如下所示。

金属铜的一个晶胞中的铜原子数与Cu2O一个晶胞中的铜原子数之比为_______。
16. 尼龙66机械强度高,刚性大,广泛用于制造机械、汽车、电气装置的零件,其结构简式如下所示。
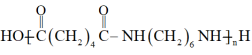 (尼龙66)
(尼龙66)
尼龙66的合成与氯碱工业结合。
(1)制备 。
。![]() 是_______分子(填“非极性”或“极性”)。
是_______分子(填“非极性”或“极性”)。
(2)尼龙66的一种合成路线如下所示。

①A属于芳香烃,其结构简式是_______。
②B→![]() 的反应类型是_______。
的反应类型是_______。
③D存在顺反异构体,生成D的化学方程式是_______。
④生成尼龙66![]() 化学方程式是_______。
化学方程式是_______。
(3)C、F反应合成尼龙66时,通过蒸出_______(填物质)来促进反应![]()
(4)上述合成F的路线生产效率不高。为提高生产效率,科学家研发出了经由电解合成F的方法:
![]() 。
。
其中电解反应如下:
阳极:![]()
阴极:![]()
生成M的总反应方程式是_______。与其他有机合成相比,电有机合成具有反应条件温和、反应试剂纯净和生产效率高等优点。
17. 某钙钛矿![]() 是一种新型半导体材料,用于制造太阳能电池。可用
是一种新型半导体材料,用于制造太阳能电池。可用![]() 制备钙钛矿。
制备钙钛矿。
(1)晶体![]() 属于_______。
属于_______。
A.离子晶体 B.分子晶体 C.共价晶体
(2)设计实验比较![]() 在
在![]() 、水中的溶解性:_______。
、水中的溶解性:_______。
(3)制备![]() 的过程如下所示:
的过程如下所示:
![]()
①Ⅰ中,![]() 的沸点高于
的沸点高于![]() 的沸点,原因是
的沸点,原因是![]() 分子间存在_______。
分子间存在_______。
②Ⅱ中,由于![]() 分子中的_______具有孤电子对,容易与
分子中的_______具有孤电子对,容易与![]() 反应生成盐
反应生成盐![]() 。
。
(4)钙钛矿的稳定性受空气中![]() 、紫外线等因素的影响。
、紫外线等因素的影响。
ⅰ.![]()
ⅱ.![]()
研究发现,一旦生成HI,钙钛矿的分解程度就会增大,请结合化学平衡移动原理解释:_______。
我国研究人员利用聚乙二醇有效地解决了该问题。
(5)在钙钛矿中引入有机物M能抑制离子扩散,增加其稳定性。M的逆合成分析如下:
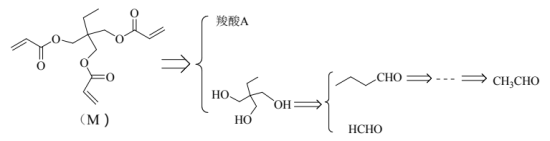
①羧酸A的结构简式为_______。
②以乙醇为起始原料,选用必要的无机试剂合成![]() ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_______
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_______
已知:![]() + R'-CH2CHO
+ R'-CH2CHO![]()

![]()
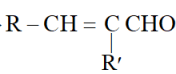 (R、R'表示烃基或氢)。
(R、R'表示烃基或氢)。
18. 分子结构修饰在药物设计与合成中有广泛的应用。
(1)有机物A(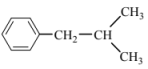 )是一种医药中间体。A属于_______(填物质类别)。
)是一种医药中间体。A属于_______(填物质类别)。
(2)研究发现,在A中取代基的对位上引入“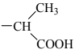 ”,其抗炎活性更好。基于此,科研人员合成了具有抗炎、镇痛、解热作用的药物——布洛芬。
”,其抗炎活性更好。基于此,科研人员合成了具有抗炎、镇痛、解热作用的药物——布洛芬。
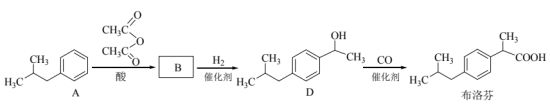
①B的结构简式是_______。
②D与布洛芬的相对分子质量相差_______。
③口服布洛芬对胃、肠道有刺激。用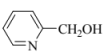 对布洛芬进行成酯修饰,能有效改善这种状况,二者发生酯化反应的化学方程式是_______。
对布洛芬进行成酯修饰,能有效改善这种状况,二者发生酯化反应的化学方程式是_______。
(3)如果对布洛芬既进行成酯修饰,又将其转变为高分子,则不仅增加它的治疗效果,还能降低毒性。科研人员对布洛芬的分子结构修饰如下:
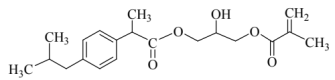 (有机物Q)
(有机物Q)
①分析Q的结构,使其发生加聚反应的官能团是_______。
②从反应类型的角度说明布洛芬与Q的性质差异:_______(答出两点即可)。
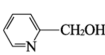
(4)Y是制备有机物Q的物质之一,其合成路线如下:

①试剂a是_______。
②E→F的反应方程式是_______。
可用酰胺类物质继续修饰有机物Q,得到性能更优异的药物。
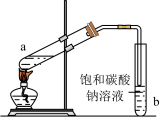
19. 学习小组探究乙酸乙酯的制备与水解,加深对酯化反应和酯的水解的认识。
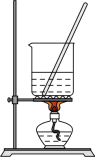
【实验一】制备乙酸乙酯
实验装置 | 实验步骤 |
| ⅰ. ⅱ.在b中加入3mL饱和 ⅲ.点燃酒精灯,小火加热 |
(1)a中生成乙酸乙酯的化学方程式为_______。
(2)a中加入碎瓷片的作用是_______。
(3)本实验中既要对反应物加热,但又不能使温度过高,原因是_______。
【实验二】探究乙酸乙酯在中性、酸性、碱性溶液中的水解(65℃水浴加热)
实验序号 | 体积/mL | |||
乙酸乙酯 | 水 |
|
| |
Ⅰ | 4 | 4 | 0 | 0 |
Ⅱ | 4 | 0 | 4 | 0 |
Ⅲ | 4 | 0 | 0 | 4 |
(4)![]() _______mol/L。
_______mol/L。
(5)实验Ⅰ~Ⅲ中,酯层减少的体积随时间的变化如下图所示。
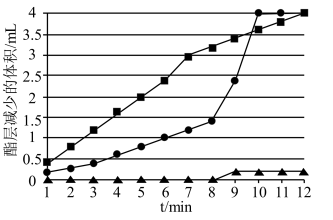
①实验Ⅲ中发生反应的化学方程式是_______。
②针对实验Ⅱ中酯层消失的时间少于实验Ⅲ,提出假设:部分乙酸乙酯溶解于Ⅱ中的溶液。探究如下:
步骤ⅰ.向试管中加入2mL水,再依次加入2mL乙酸乙酯、1mL乙醇、1mL乙酸,振荡后互溶,得到溶液X。
步骤ⅱ.取少量溶液X,_______(填操作和现象)。证实假设合理。
(6)实验一中,能否用浓NaOH溶液代替饱和![]() 溶液?判断并解释:_______。
溶液?判断并解释:_______。
2020-2021年北京市朝阳区高二化学下学期期末试题参考答案
第一部分(选择题,共42分)
每小题只有一个选项符合题意。共14个小题,每小题3分,共42分
【1】C 【2】C 【3】B 【4】C 【5】D
【6】A 【7】B 【8】C 【9】D 【10】C
【11】D 【12】B 【13】D 【14】D
第二部分(非选择题,共58分)
15.(1) ①. 2-甲基丁烷(异戊烷) ②. sp、sp3
(2) ①. ![]() ②. H2O ③. 离子键、共价键 ④.
②. H2O ③. 离子键、共价键 ④. ![]()
(3)Cu2O+H2=2Cu+H2O
(4)1:1
16.(1)非极性分子
(2) ①. 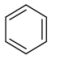 ②. 加成反应 ③.
②. 加成反应 ③. ![]() CH2ClCH=CHCH2Cl ④.
CH2ClCH=CHCH2Cl ④. ![]() +
+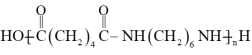
(3)![]()
(4)![]()
17.(1)B (2)向碘水中加入![]() ,振荡,溶液分层,下层呈紫红色
,振荡,溶液分层,下层呈紫红色
(3) ①. 氢键 ②. N(氮原子)
(4)![]() (或
(或![]() ),HI浓度减小,使上述平衡正向移动
),HI浓度减小,使上述平衡正向移动
(5) ①. ![]() ②.
②. ![]()
![]()
![]()
![]()
18.(1)芳香烃 (2) ①. 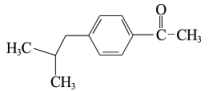 ②. 28 ③.
②. 28 ③. 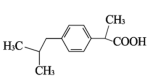 +
+
![]()
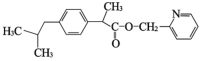 +H2O
+H2O
(3) ①. 碳碳双键 ②. Q能够发生水解反应、消去反应、加聚反应:布洛芬能发生中和反应
(4) ①. NaOH水溶液 ②. ![]()
19.(1)![]()
(2)防止暴沸 (3)加热是为了提高化学反应速率:温度过高会发生副反应、反应物挥发,转化率降低
(4)4 (5) ①. ![]() ②. 向溶液X中加入氢氧化钠溶液,振荡,溶液分层
②. 向溶液X中加入氢氧化钠溶液,振荡,溶液分层
(6)不能,浓氢氧化钠溶液会使乙酸乙酯水解程度增大,水解速率加快