2014年陕西普通高中会考化学真题及答案
考生注意:
1.本试卷分第一部分(选择题)和第二部分(非选择题)两部分。满分100分,考试时间90分钟。
2.请将第一部分的答案填写在第二部分相应的答题栏内,交卷时只交第二部分。
可能用到的相对原子质量: H—1 C—12 N—14 O—16 Na—23 Al—27
S—32 Cl—35.5 Fe—56 Cu—64
第一部分(选择题 共50分)
一、选择题(本题包括10小题,每小题2分,计20分。每小题只有一个正确答案,多选、不选或错选均不给分)
1.2007年我国首颗探月卫星“嫦娥一号”发射成功,其绕月飞行的目的之一是探测月球土壤中核聚变材料![]() 的含量。据报道,月球的土壤中吸附着数百万吨的
的含量。据报道,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以![]() 的形式存在。下列说法正确的是 ( )
的形式存在。下列说法正确的是 ( )
A.![]() 原子核内含有4个质子
原子核内含有4个质子
B.![]() 和
和![]() 互为同位素
互为同位素
C.![]() 原子核内含有3个中子
原子核内含有3个中子
D.![]() 的最外层电子数为2,所以
的最外层电子数为2,所以![]() 具有较强的金属性
具有较强的金属性
2.下列说法正确的是 ( )
A.摩尔是国际单位制七个基本物理量之一
B.Cl2的摩尔质量是71 g/mol
C.标准状况下,22.4LH2O的物质的量为1mol
D.1molH2的质量是1g
3.实验室中,有关试剂的保存方法错误的是 ( )
A.烧碱溶液保存在带玻璃塞的试剂瓶中
B.液溴用水封保存
C.少量金属钠保存在煤油中
D.浓硝酸保存在棕色细口瓶中
4.下列实验现象描述正确的是 ( )
A.氯化氢与氨气相遇,有大量的白雾生成
B.用铂丝蘸取硫酸钠溶液灼烧,火焰呈黄色
C.氯化亚铁溶液与无色的KSCN溶液混合,溶液呈红色
D.SO2通入品红溶液,红色褪去,再加热,红色不再出现
5.容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、
②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 ( )
A.②④⑥ B.③⑤⑥ C.①②④ D.①③⑤
6.在下列反应中水既不是氧化剂,也不是还原剂的氧化还原反应是 ( )
A.氯气溶于水 B.金属钠溶于水
C.三氧化硫溶于水 D.氟气通入水中
7.通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,是为了加快化学反应速率的是 ( )
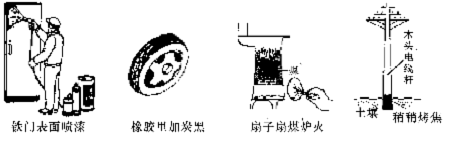
A B C D
8.有关化学用语正确的是 ( )
A.乙烯的最简式C2H4 B.乙醇的结构简式C2H6O
C.四氯化碳的电子式 D.臭氧的分子式O3
9.在强酸性溶液中,可以大量共存的离子是 ( )
A.K+、Na+、SO![]() 、CO
、CO![]() B.NH
B.NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、Cl﹣
、Cl﹣
C.Na+、K+、HCO![]() 、Cl﹣ D.K+、Na+、AlO
、Cl﹣ D.K+、Na+、AlO![]() 、NO
、NO![]()
10.现有三组溶液,汽油和水的混合物;汽油和柴油的混合物;氯化钠和单质碘的水溶液,分离以上各混合物的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
二、选择题(本题包括10小题,每小题3分,计30分。每小题只有一个正确答案,多选、不选或错选均不给分)
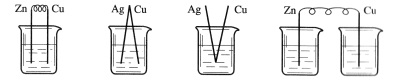 11.下列装置烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是( )
11.下列装置烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是( )
A B C D
12.下列实验现象描述正确的是 ( )
A.氯化氢与氨气相遇,有大量的白雾生成
B.用铂丝蘸取硫酸钠溶液灼烧,火焰呈黄色
C.氯化亚铁溶液与无色的KSCN溶液混合,溶液呈红色
D.SO2通入品红溶液,红色褪去,再加热,红色不再出现
13.下列关于苯的说法中,正确的是 ( )
A.在空气中燃烧时产生较多的黑烟
B.分子中含有三个C-C键和三个C=C键
C.分子中C、H元素的质量为6:1
D.通入氢气即可发生加成反应
14.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
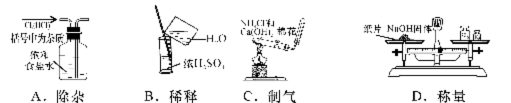 ( )
( )
15. “绿色化学”是21世纪化学科学发展的重要方向之一,其核心是从源头上减少对环境的污染。你认为“绿色化学”是指化学工业生产中 ( )
A.对废气、废水、废渣进行严格处理
B.少用或不用有害物质以及少排或不排放有害物质
C.不使用任何化学物质
D.在化工厂种草、种树,使其成为花园式工厂
16.据报导,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普通使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不正确的是 ( )
A.硅是一种洁净的能源,其燃烧产物SiO2粉尘对环境无污染
B.由1mol Si在空气中完全燃烧放出858.6KJ热量可知,硅燃烧放出的热量大
C.自然界硅的贮存量丰富
D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
17.历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的是 ( )
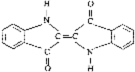 A.靛蓝由碳、氢、氧、氮四种元素组成
A.靛蓝由碳、氢、氧、氮四种元素组成
B.它的分子式是C16H10N2O2
C.该物质是高分子化合物
D.它是芳香族有机物
18.在一条件下,反应N2+3H2![]() 2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为( )
2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为( )
A.1.2mol·L﹣1·min﹣1 B.1.0 mol·L﹣1·min﹣1
C.0.6 mol·L﹣1·min﹣1 D.0.4 mol·L﹣1·min﹣1
19.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染之一而加以控制。铝在下列场合须加以控制的是①制铝锭②制易拉罐③制电线电缆④制牙膏皮⑤用明矾净水⑥制炊具⑦用明矾和小苏打作出食物膨化剂⑧用Al(OH)3制成胃药 ⑨制防锈油漆 ( )
A.①②④⑤⑥⑦ B.②④⑤⑥⑦⑧
C.②⑤⑥⑦⑧⑨ D.③④⑤⑥⑦⑧
20. 将C mol·L﹣1的AlCl3溶液V1 mL加水稀释至V2mL,稀释后溶液中Cl﹣物质的量浓度为 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
答题卡
题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答 案 | ||||||||||
题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
答 案 |
题 号 | 第一部分 | 第二部分 | 总 分 | |
1—20 | 必答题 | 选答题 | ||
得 分 | ||||
第二部分 (非选择题 共50分)
得 分 | 评卷人 |
三、必答题(本题包括5小题,计30分)
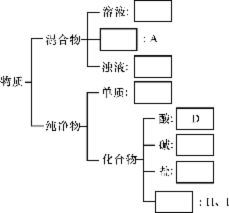 21.(7分)现有下列物质:A.豆浆 B.食盐水 C.铁 D.硫酸 E.氢氧化钠固体 F.纯碱 G.泥浆 H.二氧化碳 I.水。请将它们的序号或所属类别填充到下列方框中。
21.(7分)现有下列物质:A.豆浆 B.食盐水 C.铁 D.硫酸 E.氢氧化钠固体 F.纯碱 G.泥浆 H.二氧化碳 I.水。请将它们的序号或所属类别填充到下列方框中。
22.(3分)某些城市中使用的水煤气是将焦炭在高温下与水蒸气反应得到的:
C + H2O ![]() CO + H2 在该反应中,作为氧化剂的物质是 (填化学式),作为还原剂的物质是 (填化学式);若反应中生成了1 mol CO,则需消耗
CO + H2 在该反应中,作为氧化剂的物质是 (填化学式),作为还原剂的物质是 (填化学式);若反应中生成了1 mol CO,则需消耗
mol H2O。
23. (5分)有X、Y、Z三种元素,原子序数依次增大。X、Z的单质在常温下为气体,X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色,XZ极易溶于水,在水溶液中电离出X+和Z﹣,其水溶液能使蓝色石蕊试纸变红。Z﹣核外电子排布与氩原子相同。Y与Z元素处于同周期,其原子半径是同周期元素中最大的。
(1)试写出元素符号:X_______,Y_______, Z_______。
(2)用电子式表示Y与Z的化合物的形成过程
_______________________________________________________________
24. (6分)如图所示:已知A和E为金属单质,B是化合物且常温下为液态,F为两性化合物。按要求回答下列问题:
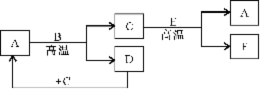
(1)E在元素周期表中位于第 周期;第 族
(2)写出A和B反应的化学方程式: 。
(3)C和E反应的化学反应方程式为 。
25.(9分)将10.7g氯化铵固体与足量熟石灰混合加热,使之充分反应。试计算:
(1)写出氯化铵与熟石灰反应的方程式。
(2)生成的氨气在标准状况下的体积是多少升?
(3)若将这些氨气配成500mL氨水,该氨水的物质的量浓度是多少?
得 分 | 评卷人 |
四、选答题(本题分三个模块,每个模块包括3道小题,计20分。考生任选一个模块作答,不跨模块计分。)
化学与生活(选修模块)
26.(6分)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+![]() Fe3+的转化时,①中的Fe2+作 剂,②中的Fe3+作 剂;
Fe3+的转化时,①中的Fe2+作 剂,②中的Fe3+作 剂;
(2)“服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中作 剂,具有 性;
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐。此反应的离子方程式为 。
27.(6分)色香味俱佳、口感好的食品深受人们的喜爱。为了提高食品的质量,在生产过程中往往会加入一些能改变食品某些性质的物质(即食品添加剂)。
(1)味精是常用的一种鲜味剂,其有效成份是L-谷氨酸钠,它的结构简式是,
![]() ,该物质分子中所含的官能团有 和 (填
,该物质分子中所含的官能团有 和 (填
写名称)。
(2)碳酸氢钠是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变得疏松。试写出碳酸氢钠受热分解的化学方程式 。
28.(8分)目前地球环境污染问题越来越严重,如温室效应、臭氧层破坏、光化学烟雾事件、酸雨的形成、有毒物质的污染等已成为世界各国普遍关注和研究的问题。请回答:
(1)产生温室效应的原因主要是大气中含有大量的 (填序号,下同)。
A.SO2 B.NO2 C.CO2 D.CO
(2)臭氧层的破坏导致紫外线对地球表面辐射的增加,从而使全球皮肤癌的发病率明显增加。造成这一现象的主要原因是 。
A.人们大量使用了氟氯烃
B.人们在炼钢时向空气中排放了大量高炉煤气
C.石油炼制厂排放了大量甲烷、氢气
D.硝酸、硫酸工厂排放了大量的二氧化碳和一氧化氮
(3)在上世纪60年代,一些工业发达国家的城市都相继发生过光化学烟雾事件,并造成数以千计的人员伤亡,光化学烟雾事件产生的主要原因是 。
A.汽油的不完全燃烧 B.大量使用了化肥和农药
C.白色塑料垃圾的漂浮 D.金属矿物的冶炼
(4)为了减少大气中二氧化碳的含量,下列措施不可行的是 。
A.改进能源结构 B.提高能源利用率
C.大量使用化石燃料 D.提倡植树种草
化学反应原理(选修模块)(共20分)
26.(6分)称取2份一定质量的锌,分别盛在2支试管中,按下列要求另加物质后,塞上带导管的塞子,定时测定生成氢气的体积。
A.试管中加入pH=3的盐酸50mL;
B.试管中加入pH=3的醋酸50mL。
若反应终了时生成的氢气一样多,且没有剩余的锌。那么
(1)开始时反应速率的大小为A B。(填“<”、“>”或“=”)
(2)2支试管中参加反应的锌的质量A B。(填“<”、“>”或“=”)
(3)反应终了所需时间A B。(填“<”、“>”或“=”)
27.(7分)依据氧化还原反应:2Ag+(aq) + Cu(s) Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
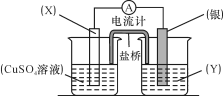
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
28.(7分)已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(
O2(g)=H2O(![]() ); △H=﹣285kJ/mol
); △H=﹣285kJ/mol
②H2(g)+![]() O2(g)=H2O(g); △H=﹣241.8kJ/mol
O2(g)=H2O(g); △H=﹣241.8kJ/mol
③C(s)+![]() O2(g)=CO(g); △H=﹣110.4kJ/mol
O2(g)=CO(g); △H=﹣110.4kJ/mol
④C(s)+ O2(g)=CO2(g); △H=﹣393.5kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是_________________________________;
(2)C的燃烧热为_________________;
(3)燃烧10g H2生成液态水,放出的热量为 ;
(4)CO燃烧的热化学方程式为 。
有机化学基础(选修模块)
26.(6分)某化工厂的废液主要含有乙醇,还溶有苯酚和乙酸。现欲从废液中回收这三种物质,设计了以下回收实验方案。
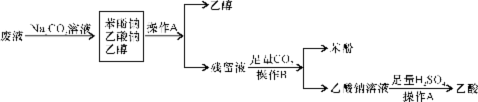
请回答:
(1)写出上述实验过程中有关操作的名称:操作A ;操作B
(2)写出残留液与足量CO2反应生成苯酚的化学方程式: 。
27.(6分)某链烃A有下列的转化关系
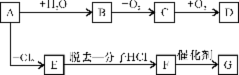
已知:D的式量为60,它的水溶液能使石蕊试液变红,G是高分子化合物。
(1)A的结构简式是 。
(2)C物质的官能团的名称是 。
(3)F→G的反应类型的是 。
28.(8分)化学式为C8H10O的化合物A 具有如下性质:
①A+Na→慢慢产生气泡 ②A+RCOOH![]() 有香味的产物
有香味的产物
③A![]() 苯甲酸 ④催化脱氢产物不能发生银镜反应
苯甲酸 ④催化脱氢产物不能发生银镜反应
⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成主要的“白色污染”源之一)。
试回答:
(1)根据上述信息,对该化合物的结构可作出的判断是 (多选扣分);
A.苯环上直接连有羟基 B.肯定有醇羟基
C.苯环侧链末端有甲基 D.肯定是芳香烃
(2)化合物A的结构简式 ;
(3)A发生催化脱氢反应的化学方程式 ;
(4)A与甲酸反应生成的酯的结构简式为 。
参考答案
一、选择题(每小题2分,计20分)
1~5BBACD 6~10ACDBC
二、选择题(每小题3分,计30分)
11~15ABACB 16~20ACCBD
三、必答题(本题包括5小题,计30分)
21.(7分)(自上而下)B 胶体 G C D E F 氧化物
22.(3分)H2O C 1
23.(5分)(1)H、Na、Cl(3分) (2)电子式略(2分)
24.(6分)(1)三;ⅢA (2)3Fe +4 H2O(g) Fe3O4 + 4H2
(3)3Fe3O4 + 8Al 4Al2O3 + 9Fe
25.(9分)
(1)2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2 (2分)
(2)4.48L (3分)
(3)0.4mol/L(4分)
四、选答题(本题包括3小题,计20分)
化学与生活(选修模块)(共20分)
26.(6分)(1)还原;氧化(每空1分)
(2)还原;还原(每空1分) (3)Fe+2H+=Fe2++H2↑(2分)
27.(6分)(1)羧基、氨基(4分)
(2)2NaHCO3 Na2CO3+H2O+CO2↑(2分)
28.(8分)(1)C (2)A (3)A (4)C (每空2分)
化学反应原理(选修模块)(共20分)
26.(6分)(1)= (2)= (3)>(每空2分)
27.(7分)(1)Cu AgNO3(2分)
(2)正极 Ag+ +e-=Ag↓ Cu-2e-=Cu2+ (3分)
(3)X Ag(2分)
28.(7分)(1)①②③④(2分) (2)393.5 kJ/mol(2分)
(3)1425 kJ(1分) (4)CO(g)+![]() O2(g)=CO2(g); △H=﹣283.1kJ/mol。(2分)
O2(g)=CO2(g); △H=﹣283.1kJ/mol。(2分)
有机化学基础(选修模块)(共20分)
26.(6分)
(1)蒸馏(1分) 分液(1分)
(2)![]() (4分)
(4分)
27.(6分)(1)CH2=CH2 (2分) (2)醛基(2分) (3)加聚(2分)
28.(8分)(1)BC (2分)
![]() (2)阶段 (2分)
(2)阶段 (2分)
![]() (3) (2分)
(3) (2分)
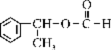
(4) (2分)